Liofilizowany lizat Escherichia coli do stosowania w immunoprofilaktyce nawracających zakażeń układu moczowego (nZUM) u kobiet wg wytycznych polskich towarzystw naukowych1-3
Immunoprofilaktyka rekomendowana w nawracających zakażeniach układu moczowego przed profilaktyką antybiotykową1-3

Uro-Vaxom® (OM‑89) to jedyny dostępny w Polsce lek zawierający liofilizowany lizat Escherichia coli
Wytyczne
Udowodniona skuteczność
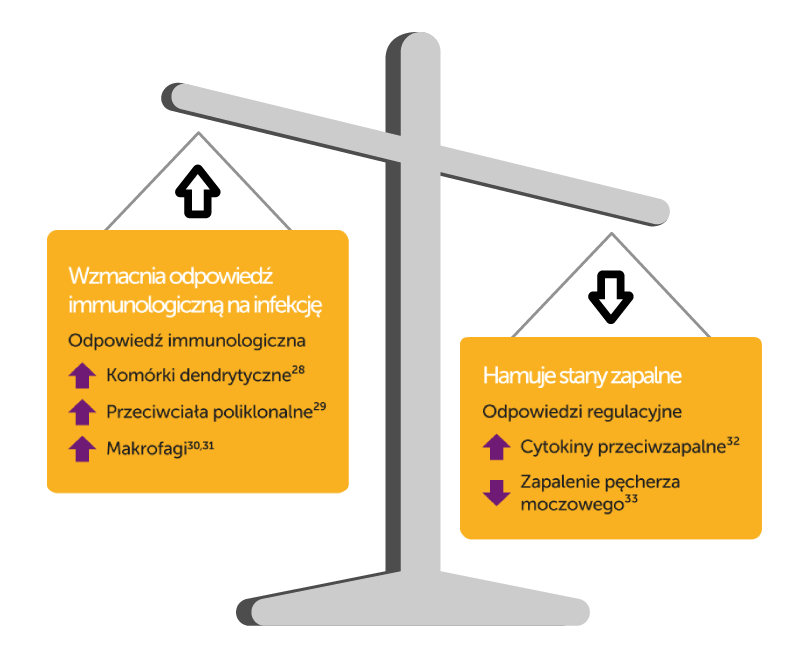
Zdrowie fizyczne
Jakość życia
Dla kogo jest Uro-Vaxom® (OM‑89)?
Wskazania:
- Zapobieganie nawracającym zakażeniom dolnego piętra układu moczowego u dorosłych i u dzieci po skończonym 4. roku życia9.
- Wspomagająco w leczeniu ostrych zakażeń układu moczowego u dorosłych i u dzieci po skończonym 4. roku życia9.
Skład:
Zobacz, jak działa Uro‑Vaxom® (OM‑89)
- 4 metaanalizy12-14
- 18 badań klinicznych15-27
- ponad 2400 przebadanych pacjentów – w tym pacjenci z urazem kręgosłupa, kobiety w okresie menopauzy, kobiety w ciąży i dzieci.
Uro-Vaxom® (OM-89) to
WIĘCEJ ODPORNOŚCI
Uro-Vaxom® (OM-89) to
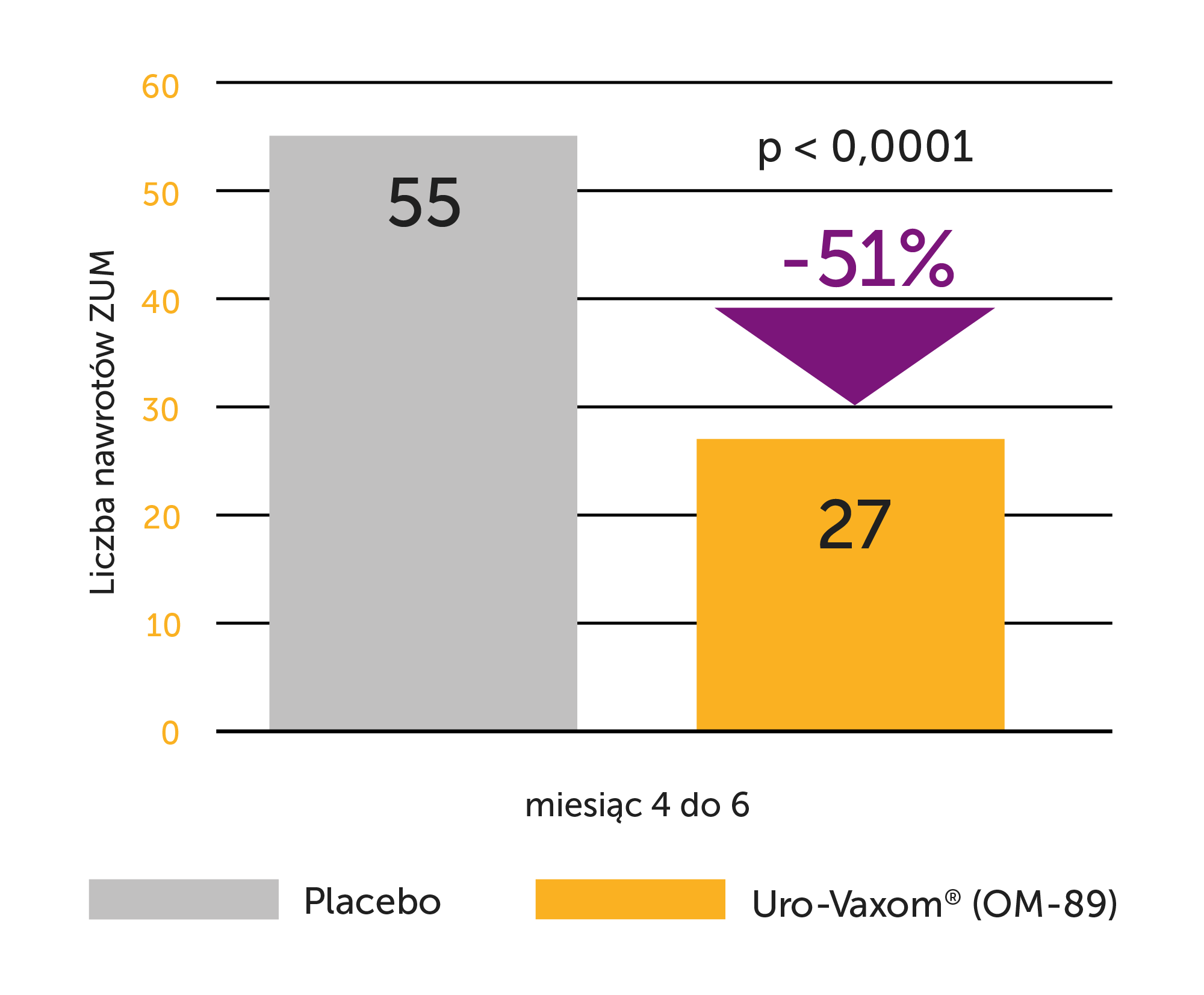
MNIEJ NAWROTÓW
Uro-Vaxom® (OM-89) to
MNIEJ ANTYBIOTYKÓW
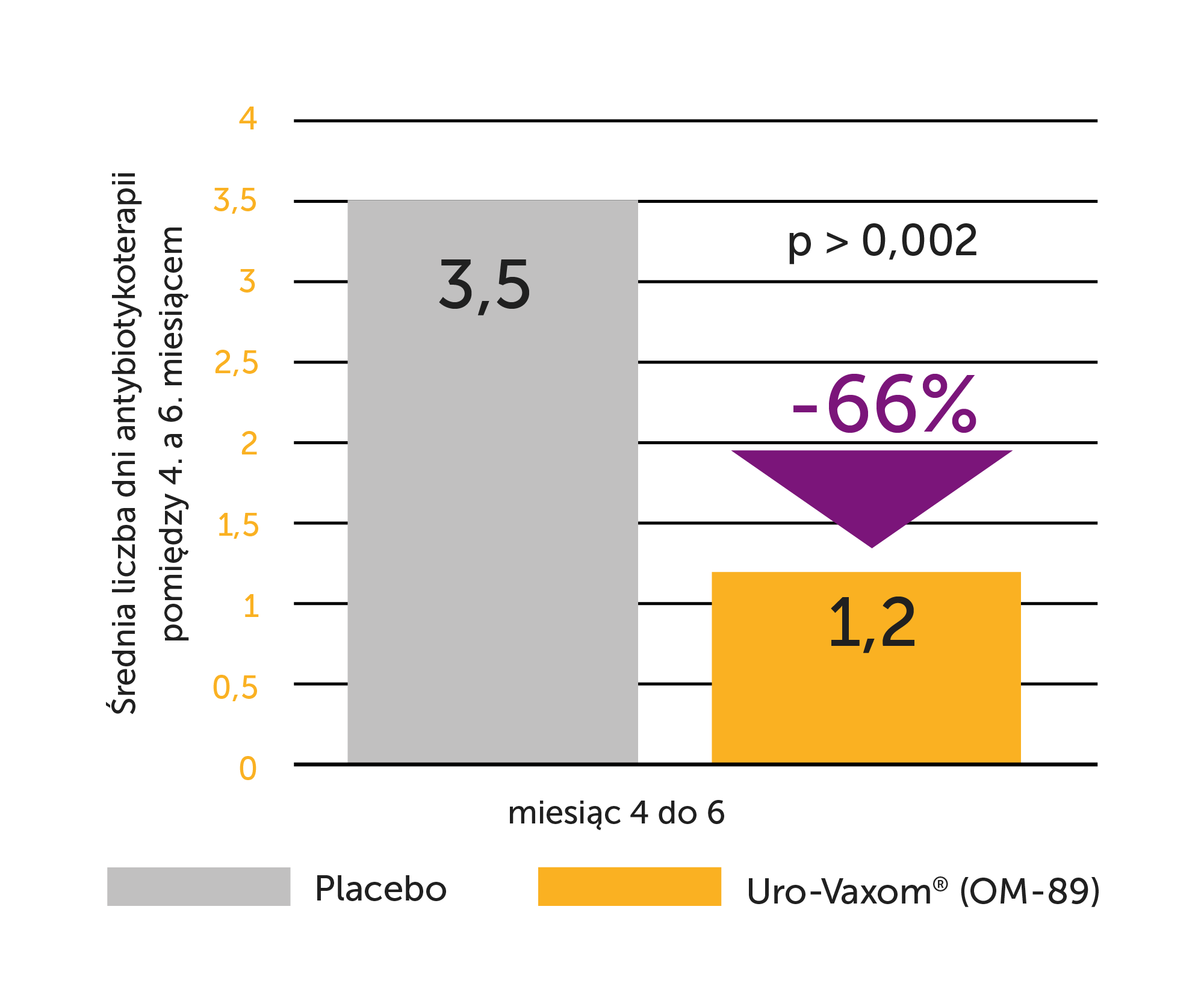
Więcej odporności, mniej nawrotów, mniej antybiotyków w nZUM!





Kiedy zastosować Uro-Vaxom® (OM-89)?
1. Zapobieganie nawracającym zakażeniom dolnego odcinka układu moczowego
Zastosuj, jeśli ZUM wystąpiło drugi raz w ciągu 6 miesięcy lub trzeci raz w ciągu roku (nZUM)1-3.
Zastosuj w nZUM od razu w ostrym zakażeniu razem z terapią antybiotykową9.
Jeśli nZUM, to zastosuj nie czekając na wynik posiewu – Uro-Vaxom® stymuluje wydzielanie przeciwciał aktywnych wobec wielu różnych bakterii4.


1 kapsułka na dobę, przed posiłkiem do ustąpienia objawów, ale przez co najmniej 10 kolejnych dni. Uro-Vaxom jest produktem wspomagającym podstawową terapię przeciwbakteryjną9.
Piśmiennictwo:
1. Juszczak K., Dybowski B., Holecki M., Hryniewicz W., Klimek H., Kłoda K., Sieroszewski P., Drewa T.: Wytyczne Towarzystw Naukowych (PTU, PTGiP, PTMR) dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych. Przegląd Urologiczny 2024/2 (tom 142), 14-35.
2. Juszczak K., Dybowski B., Holecki M., Hryniewicz W., Klimek H., Kłoda K., Sieroszewski P., Drewa T.: Wytyczne Polskiego Towarzystwa Urologicznego, Polskiego Towarzystwa Ginekologów i Położników oraz Polskiego Towarzystwa Medycyny Rodzinnej dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych. Ginekologia i Perinatologia Praktyczna 2024/2 (tom 9), 133-153.
3. Juszczak K., Dybowski B., Holecki M., Hryniewicz W., Klimek H., Kłoda K., Sieroszewski P., Drewa T.: Wytyczne Towarzystw Naukowych (PTU, PTGiP, PTMR) dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych. Lekarz POZ 2024/10, 127-148.
4. Huber M, Baier W, Serr A, Bessler WG. Immunogenicity of an E. coli extract after oral or intraperitoneal administration: induction of antibodies against pathogenic bacterial strains. Int J Immunopharmacol. 2000; 22: 57-68.
5. Huber M, Krauter K, Winkelmann G et al. Immunostimulation by bacterial components: Efficacy studies and meta-analysis of the bacterial extract OM-89. Int J immunopharmacol. 2000;22:1103-1111.
6. Schulman C et al. Oral immunotherapy of recurrent urinary tract infections: A double-blind, placebo-controlled, multicenter study. J Urol. 1993;150:917-921.
7. Magasi P, Panovics J, Illes A, Nagy M. Uro-Vaxom® and the management of recurrent urinary tract infection in adults: a randomized multicenter double-blind trial. Eur Urol. 1994;26:137-140.
8. Renard J, Ballarini S, Mascarenhas T et al. Recurrent Lower Urinary Tract Infections Have a Detrimental Effect on Patient Quality of Life: a Prospective, Observational Study. Infect Dis Ther. 2015; 4(1):125–135.
9. Charakterystyka Produktu Leczniczego Uro-Vaxom®.
10. Hryniewicz W, red. nauk. Rekomendacje diagnostyki, terapii i profilaktyki zakażeń układu moczowego u dorosłych. Narodowy Instytut Leków, Warszawa 2015.
11. Bonkat G, Bartoletti R, Bruyere F et al. EAU Guidelines on urological infections. European Association of Urology 2024. https://uroweb.org/guidelines/urological-infections/chapter/the-guideline (dostęp: 01.2025).
12. Bauer HV, Rahlfs VW, Lauener PA, Blessmann GS. Prevention of recurrent urinary tract infections with immuno-active E. coli fractions: a meta-analysis of five placebo controlled double-blind studies. Int J Antimicrob Agents 2002; 19: 451-456.
13. Naber KG, Cho YH, Matsumoto T, et al. Immunoactive prophylaxis of recurrent urinary tract infections: a meta-analysis. Int J Antimicrob Agents. 2009;33(2):111-119.
14. Beerepoot MAJ, Geerlings SE, van Haarst EP, et al. Nonantibiotic prophylaxis for recurrent urinary tract infections: a systematic review and meta-analysis of randomized controlled trials. J Urol 2013; 190: 1981-1989.
15. Frey C, Obolensky W, Wyss H. Treatment of recurrent urinary tract infections: efficacy of an orally administered biological response modifier. Urol Int 1986; 41: 444-446.
16. Tammen H. The German Urinary Tract Infection Study Group. Immunobiotherapy with Uro-Vaxom in recurrent urinary tract infection. Br J Urol 1990; 65: 6-9.
17. Hachen, H. J. Oral immunotherapy in paraplegic patients with chronic urinary tract infections: a double-blind, placebo-controlled trial. J. Urol 1990. 143:759-763.
18. Rugendorff EW: Immunological therapy of recurrent urinary tract infections with immunoactive E. coli fractions in women. Int Urogynecol J 1992;3:179–184.
19. Schulman CC, Corbusier A, Michiels H, Taenzer JH. Oral immunotherapy of recurrent urinary tract infections: a double-blind placebo-controlled multicenter study. J Urol 1993; 150: 917-921.
20. Magasi P, Pánovics J, Illés A, Nagy M. Uro-Vaxom and the management of recurrent urinary tract infection in adults: a randomized multicenter double-blind trial. Eur Urol 1994; 26: 137-140.
21. Lettgen B: Prevention of recurrent urinary tract infections in female children. OM-89 therapy compared with nitrofurantoin prophylaxis in a randomized pilot study. Curr Ther Res 1996;57:464–475.
22. Popa G, Lauber KD, Rothe H, Rugendorff E: Rezidivierende Harnwegsinfektionen in der Postmenopause. Wirksamkeit einer oralen Immuntherapie mit E. coli Fraktionen. Münch Med Wschr 1996;138:713–716.
23. Czerwionka-Szaflarska M, Pawłowska M: Influence of Uro-Vaxom on sIgA level in urine in children with recurrent urinary tract infections. Arch Immunol Ther Exp (Warsz) 1996; 44: 195–197.
24. Brodie A. et al. A Retrospective Study of Immunotherapy Treatment with Uro-Vaxom (OM-89®) for Prophylaxis of Recurrent Urinary Tract Infections. Curr Urol 2020;14:130–134.
25. Derick T Wade, James Cooper, Nicholas Peckham, and Maurizio Belci. Immunotherapy to reduce frequency of urinary tract infections in people with neurogenic bladder dysfunction; a pilot randomised, placebo-controlled trial.Clin Rehabil. 2020 Dec; 34(12): 1458–1464.
26. Baertschi R, Balmer JA, Eduah SB, Liechti A, Lurie D, Schams H: Bacterial extract for the prevention of recurrent urinary tract infections in pregnant women: a pilot study. Int J Immunother 2003;19:25–31.
27. Bauer HW, Alloussi S, Egger G, et al. Multicenter UTI Study Group. A long-term, multicenter, double-blind study of an Escherichia coli extract (OM-89) in female patients with recurrent urinary tract infections. Eur Urol 2005; 47: 542-548.
28. Schmidhammer S et al. An Escherichia coli-based oral vaccine against urinary tract infections potently activates human dendritic cells. Urology. 2002;60(3):521-526.
29. Huber M et al. Immunostimulatory activity of the bacterial extract OM-89. Eur J Med Res. 2000;5(3):101-109.
30. Bessler WG et al. Immunostimulatory properties of the bacterial extract OM-89 in vitro and in vivo. Arzneimittelforschung. 2010;60:324-29.
31. Pham TV, Kreis B, Corradin-Betz S et al. Metabolic and functional stimulation of lymphocytes and macrophages by an Escherichia coli extract (OM-89): in vitro studies. J Biol Response Mod. 1990;9:231-240.
32. Wybran J, Libin M, Schandene L. Enhancement of cytokine production and natural killer activity by an Escherichia coli extract. Onkologie 1989;12:22-25.
33. Lee SJ, Kim SW, Cho YH et al. Anti-inflammatory effect of an Escherichia coli extract in a mouse model of lipopolysaccharide-induced cystitis. World J Urol. 2005;24:33-3.